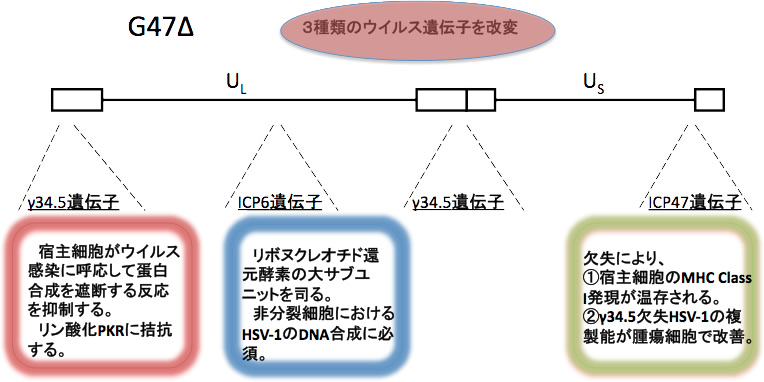
亙堛椕廬帠幰岦偗徻嵶忣曬亜
慖戰婎弨偺徻嵶忣曬
揔奿婎弨
- 慜棫態慡揈彍弍傪庴偗偢偵儂儖儌儞椕朄傪峴偭偰偄偨慜棫態娻姵幰偱丄儂儖儌儞椕朄偑柍岠偲側偭偨乮拲婰1乯偲敾抐偝傟偨姵幰丅暊崪斦晹CT専嵏傗崪僔儞僠僌儔僼傿乕偺夋憸専嵏偵偰墦妘揮堏傪擣傔傞姵幰傕娷傓丅
- 儂儖儌儞椕朄柍岠偲敾抐偝傟偨屻偱慜棫態娻偺懚嵼偑昦棟妛揑偵妋擣偝傟偨姵幰丅
- Performance Status (PS)偑0傑偨偼1偱偁傞偙偲
- 擭楊20嵨埲忋
- 6儢寧埲忋偺惗懚偑尒崬傑傟傞偙偲
- 庡梫憻婍偺婡擻偑惓忢偱偁傞偙偲
- G47儮搳梌屻彮側偔偲傕6儢寧娫偼僶儕傾宆旔擠傪幚峴偡傞堄巚偑偁傞偙偲
- 暥彂偱僀儞僼僅乕儉僪僐儞僙儞僩傪峴偆擻椡偲堄巚偑偁傞偙偲丅
拲婰1丗 儂儖儌儞帯椕拞偱偁傞偵傕偐偐傢傜偢丄寣惔PSA偺桳堄側忋徃乮2廡娫埲忋偺娫妘偱偺3夞偺應掕偵偍偄偰楢懕揑偵忋徃乯偡傞姵幰傪乽儂儖儌儞椕朄柍岠徢椺乿偲掕媊偡傞丅寣拞僥僗僩僗僥儘儞抣偑1.0ng/ml埲壓偱偁傞偙偲傕妋擣偡傞丅峈傾儞僪儘僎儞嵻傪暪梡偟偰偄傞徢椺偱偼丄搳栻傪拞巭偟峈傾儞僪儘僎儞彍嫀徢岓孮偱側偄偙偲傪妋擣偡傞丅
彍奜婎弨
| 1乯婛墲楌 | 嘆HIV梲惈傑偨偼偦偺婛墲 嘇偦偺懠丄堛妛揑偁傞偄偼惛恄揑堎忢偺偨傔丄僾儘僩僐儖帯椕傪弲庣偡傞偙偲偑崲擄偱偁傞偲巚傢傟傞応崌 |
|---|---|
| 2乯椪彴専嵏抣 | 嘆敀寣媴 亝 3.0 x 103/mm3丄岲拞媴 亝1.0 x 103/mm3丄寣彫斅 亝 100,000/mm3丄Hb 亝9.0 g/dl丄INR >惓忢抣偺1.3攞丅 嘇寣惔僋儗傾僠僯儞亞 1.7mg/dl丅 嘊娞僩儔儞僗傾儈僫乕僛 乮AST傑偨偼ALT乯 > 惓忢抣偺4攞丅 嘋憤價儕儖價儞傑偨偼捈愙價儕儖價儞 > 1.5mg/dl丅 |
| 3乯暪懚幘姵 | 嘆妶摦惈偺僿儖儁僗僂僀儖僗姶愼偺懚嵼丅 嘇慜棫態娻埲奜偺妶摦惈偺埆惈庮釃偺懚嵼丅 嘊妶摦惈偱僐儞僩儘乕儖偝傟偰偄側偄姶愼徢偺懚嵼丅 嘋傾儖僐乕儖傑偨偼懠偺栻暔拞撆偺懚嵼丅 嘍僐儞僩儘乕儖晄椙傑偨偼廳搙偺怱晄慡丒摐擜昦丒崅寣埑丒娫幙惈攛墛丒恡晄慡丒帺屓柶塽幘姵側偳丅 |
| 4乯傾儗儖僊乕楌 | 峈HSV栻乮傾僔僋儘價儖乯偵懳偡傞傾儗儖僊乕偺懚嵼丅 |
| 5乯暪梡栻 | 嘆30擔埲撪偺僪僙僞僉僙儖摍偺峈娻嵻偺搳梌丅 嘇30擔埲撪偺峈傾儞僪儘僎儞嵻偺搳梌丅 |
| 6乯偦偺懠 | 嘆杮尋媶嶲壛慜30擔埲撪偵枹彸擣栻偺帯尡乛椪彴尋媶偵嶲壛偟偰偄傞応崌丅 嘇堚揱巕帯椕傑偨偼僂僀儖僗椕朄偺婛墲 嘊偦偺懠丄扴摉堛巘偑晄揔愗偲敾抐偡傞応崌 |